Buy article online - an online subscription or single-article purchase is required to access this article.
The title compound, namely lithium cobalt(II/III) bis(diphosphate), Li4.03Co1.97(P2O7)2, is a new mixed-valent lithium/cobalt(II/III) phosphate. Three metal sites out of seven are occupied simultaneously by Li+ and CoII/III ions. This disorder was established both from an analysis of the atomic displacement ellipsoids and Li/Co-O bond distances, and by means of a charge-distribution (CHARDI) model, which provides satisfactory agreement on the computed charges (Q) for all the cations.
Supporting information
La synthèse a été faite par voie sèche à partir d'un mélange de
carbonate de lithium, hydrogénophospate d'ammonium et un mélange d'oxydes
de cobalt Co2O3 et Co3O4 (Co minimum 71%) dans les proportions
molaires Li:P:Co = 2:1:2. Le traitement thermiqe a été realisé en deux
étapes, la première consistant à chauffer le mélange à 673 K pendant
24 h. Après broyage, la température est amenée à 873 K et maintenue
pendant dix jours. Le mélange a été ensuite lentement refroidi jusqu'à
l'ambiante, puis lavé à l'eau bouillante. Des cristaux roses sont obtenus
et le cristal étudié a été selectionné sous une loupe binoculaire.
Data collection: CAD-4 EXPRESS (Enraf–Nonius, 1995); cell refinement: CAD-4 EXPRESS (Enraf–Nonius, 1995); data reduction: XCAD4 (Harms & Wocadlo, 1995); program(s) used to solve structure: SHELXS97 (Sheldrick, 2008); program(s) used to refine structure: SHELXL97 (Sheldrick, 2008); molecular graphics: DIAMOND (Brandenburg, 1998); software used to prepare material for publication: WinGX (Farrugia, 1999).
lithium cobalt(II/III) bis(diphosphate)
top
Crystal data top
| Li4.03Co1.97(P2O7)2 | F(000) = 949.6 |
| Mr = 491.94 | Dx = 3.169 Mg m−3 |
| Monoclinic, P21/a | Mo Kα radiation, λ = 0.71073 Å |
| Hall symbol: -P 2yab | Cell parameters from 25 reflections |
| a = 9.817 (2) Å | θ = 10–16° |
| b = 9.741 (3) Å | µ = 3.88 mm−1 |
| c = 11.012 (2) Å | T = 293 K |
| β = 101.76 (2)° | Prism, pink |
| V = 1030.9 (4) Å3 | 0.20 × 0.18 × 0.15 mm |
| Z = 4 | |
Data collection top
Enraf–Nonius CAD-4
diffractometer | Rint = 0.053 |
| Radiation source: fine-focus sealed tube | θmax = 27.0°, θmin = 2.8° |
| Graphite monochromator | h = −12→5 |
| ω/2θ scans | k = −1→12 |
| 3721 measured reflections | l = −14→14 |
| 2191 independent reflections | 2 standard reflections every 120 min |
| 1831 reflections with I > 2σ(I) | intensity decay: 1% |
Refinement top
| Refinement on F2 | 4 restraints |
| Least-squares matrix: full | Primary atom site location: structure-invariant direct methods |
| R[F2 > 2σ(F2)] = 0.038 | Secondary atom site location: difference Fourier map |
| wR(F2) = 0.100 | w = 1/[σ2(Fo2) + (0.0574P)2 + 0.0996P]
where P = (Fo2 + 2Fc2)/3 |
| S = 1.05 | (Δ/σ)max = 0.001 |
| 2191 reflections | Δρmax = 0.89 e Å−3 |
| 217 parameters | Δρmin = −0.86 e Å−3 |
Crystal data top
| Li4.03Co1.97(P2O7)2 | V = 1030.9 (4) Å3 |
| Mr = 491.94 | Z = 4 |
| Monoclinic, P21/a | Mo Kα radiation |
| a = 9.817 (2) Å | µ = 3.88 mm−1 |
| b = 9.741 (3) Å | T = 293 K |
| c = 11.012 (2) Å | 0.20 × 0.18 × 0.15 mm |
| β = 101.76 (2)° | |
Data collection top
Enraf–Nonius CAD-4
diffractometer | Rint = 0.053 |
| 3721 measured reflections | 2 standard reflections every 120 min |
| 2191 independent reflections | intensity decay: 1% |
| 1831 reflections with I > 2σ(I) | |
Refinement top
| R[F2 > 2σ(F2)] = 0.038 | 217 parameters |
| wR(F2) = 0.100 | 4 restraints |
| S = 1.05 | Δρmax = 0.89 e Å−3 |
| 2191 reflections | Δρmin = −0.86 e Å−3 |
Special details top
Geometry. All e.s.d.'s (except the e.s.d. in the dihedral angle between two l.s. planes)
are estimated using the full covariance matrix. The cell e.s.d.'s are taken
into account individually in the estimation of e.s.d.'s in distances, angles
and torsion angles; correlations between e.s.d.'s in cell parameters are only
used when they are defined by crystal symmetry. An approximate (isotropic)
treatment of cell e.s.d.'s is used for estimating e.s.d.'s involving l.s.
planes. |
Refinement. Refinement of F2 against ALL reflections. The weighted R-factor
wR and goodness of fit S are based on F2, conventional
R-factors R are based on F, with F set to zero for
negative F2. The threshold expression of F2 >
σ(F2) is used only for calculating R-factors(gt) etc.
and is not relevant to the choice of reflections for refinement.
R-factors based on F2 are statistically about twice as large
as those based on F, and R- factors based on ALL data will be
even larger. |
Fractional atomic coordinates and isotropic or equivalent isotropic displacement parameters (Å2) top| | x | y | z | Uiso*/Ueq | Occ. (<1) |
| P1 | 0.62275 (9) | 0.34876 (9) | 0.42258 (8) | 0.0063 (2) | |
| P2 | 0.56244 (9) | 0.57163 (9) | 0.24178 (8) | 0.0071 (2) | |
| P3 | 0.47904 (9) | −0.04514 (10) | 0.24202 (8) | 0.0069 (2) | |
| P4 | 0.38331 (9) | 0.20390 (9) | 0.11059 (8) | 0.0074 (2) | |
| Co1 | 0.75270 (8) | 0.78420 (8) | 0.17967 (7) | 0.0088 (3) | 0.597 (3) |
| LC1 | 0.75270 (8) | 0.78420 (8) | 0.17967 (7) | 0.0088 (3) | 0.403 (12) |
| Co2 | 0.65400 (14) | 0.07191 (14) | 0.04121 (11) | 0.0103 (5) | 0.321 (3) |
| LC2 | 0.65400 (14) | 0.07191 (14) | 0.04121 (11) | 0.0103 (5) | 0.679 (12) |
| Co3 | 0.5869 (4) | 0.3900 (4) | 0.0268 (4) | 0.0120 (14) | 0.051 (3) |
| LC3 | 0.5869 (4) | 0.3900 (4) | 0.0268 (4) | 0.0120 (14) | 0.949 (12) |
| Co4 | 0.30220 (5) | 0.43058 (5) | 0.32789 (4) | 0.00835 (15) | |
| Li4 | 0.6151 (7) | 0.7758 (7) | 0.4498 (6) | 0.0154 (14) | |
| Li5A | 0.8259 (16) | 0.5788 (16) | 0.4507 (14) | 0.019 (3) | 0.61 (2) |
| Li5B | 0.875 (3) | 0.553 (3) | 0.494 (2) | 0.019 (3) | 0.38 (2) |
| O11 | 0.4742 (3) | 0.3418 (3) | 0.4424 (2) | 0.0092 (5) | |
| O12 | 0.6174 (3) | 0.4213 (2) | 0.2905 (2) | 0.0095 (4) | |
| O13 | 0.6865 (3) | 0.2071 (3) | 0.4138 (2) | 0.0114 (5) | |
| O14 | 0.7229 (3) | 0.4345 (3) | 0.5174 (2) | 0.0101 (5) | |
| O21 | 0.5673 (3) | 0.5694 (3) | 0.1061 (2) | 0.0129 (6) | |
| O22 | 0.6658 (3) | 0.6762 (3) | 0.3121 (2) | 0.0125 (5) | |
| O23 | 0.4160 (3) | 0.5888 (3) | 0.2684 (2) | 0.0105 (5) | |
| O31 | 0.4824 (3) | −0.0852 (3) | 0.3751 (2) | 0.0117 (5) | |
| O33 | 0.6267 (2) | −0.0287 (3) | 0.2142 (2) | 0.0095 (5) | |
| O32 | 0.3893 (3) | −0.1355 (3) | 0.1440 (2) | 0.0105 (5) | |
| O34 | 0.4051 (3) | 0.1033 (3) | 0.2288 (2) | 0.0095 (4) | |
| O41 | 0.5244 (3) | 0.2202 (3) | 0.0782 (2) | 0.0116 (5) | |
| O42 | 0.3204 (3) | 0.3324 (3) | 0.1528 (2) | 0.0117 (5) | |
| O43 | 0.2806 (3) | 0.1319 (3) | 0.0032 (2) | 0.0117 (5) | |
Atomic displacement parameters (Å2) top| | U11 | U22 | U33 | U12 | U13 | U23 |
| P1 | 0.0073 (4) | 0.0025 (4) | 0.0083 (4) | 0.0006 (3) | −0.0002 (3) | 0.0008 (3) |
| P2 | 0.0089 (4) | 0.0035 (5) | 0.0085 (4) | −0.0002 (3) | 0.0008 (3) | 0.0001 (3) |
| P3 | 0.0084 (4) | 0.0036 (4) | 0.0083 (4) | 0.0000 (3) | 0.0010 (3) | 0.0001 (3) |
| P4 | 0.0083 (4) | 0.0045 (4) | 0.0088 (4) | 0.0010 (3) | 0.0002 (3) | −0.0007 (3) |
| Co1 | 0.0114 (4) | 0.0050 (4) | 0.0101 (4) | −0.0002 (3) | 0.0024 (3) | 0.0005 (3) |
| LC1 | 0.0114 (4) | 0.0050 (4) | 0.0101 (4) | −0.0002 (3) | 0.0024 (3) | 0.0005 (3) |
| Co2 | 0.0123 (7) | 0.0071 (7) | 0.0108 (7) | 0.0016 (5) | 0.0006 (5) | −0.0015 (5) |
| LC2 | 0.0123 (7) | 0.0071 (7) | 0.0108 (7) | 0.0016 (5) | 0.0006 (5) | −0.0015 (5) |
| Co3 | 0.013 (2) | 0.006 (2) | 0.017 (2) | 0.0024 (15) | 0.0018 (15) | 0.0019 (15) |
| LC3 | 0.013 (2) | 0.006 (2) | 0.017 (2) | 0.0024 (15) | 0.0018 (15) | 0.0019 (15) |
| Co4 | 0.0091 (3) | 0.0056 (3) | 0.0101 (3) | 0.00016 (18) | 0.00132 (18) | 0.00199 (17) |
| Li4 | 0.014 (3) | 0.013 (4) | 0.018 (3) | 0.005 (3) | 0.004 (3) | 0.005 (2) |
| Li5A | 0.019 (8) | 0.023 (7) | 0.017 (8) | −0.007 (6) | 0.010 (5) | −0.001 (5) |
| Li5B | 0.019 (8) | 0.023 (7) | 0.017 (8) | −0.007 (6) | 0.010 (5) | −0.001 (5) |
| O11 | 0.0087 (12) | 0.0057 (12) | 0.0127 (11) | 0.0009 (10) | 0.0009 (10) | 0.0024 (10) |
| O12 | 0.0149 (9) | 0.0029 (9) | 0.0105 (8) | 0.0033 (7) | 0.0020 (7) | 0.0020 (6) |
| O13 | 0.0127 (12) | 0.0093 (13) | 0.0127 (11) | 0.0047 (10) | 0.0040 (10) | 0.0014 (10) |
| O14 | 0.0114 (12) | 0.0060 (13) | 0.0117 (12) | −0.0023 (10) | −0.0002 (10) | −0.0036 (9) |
| O21 | 0.0176 (13) | 0.0124 (14) | 0.0085 (11) | 0.0048 (11) | 0.0021 (10) | 0.0027 (10) |
| O22 | 0.0132 (13) | 0.0088 (13) | 0.0156 (12) | −0.0066 (11) | 0.0032 (10) | −0.0049 (10) |
| O23 | 0.0098 (12) | 0.0079 (13) | 0.0139 (11) | 0.0007 (10) | 0.0030 (10) | 0.0027 (10) |
| O31 | 0.0117 (12) | 0.0112 (14) | 0.0128 (12) | 0.0050 (11) | 0.0035 (10) | 0.0034 (10) |
| O33 | 0.0094 (12) | 0.0080 (12) | 0.0112 (12) | −0.0006 (10) | 0.0023 (9) | 0.0004 (9) |
| O32 | 0.0118 (12) | 0.0046 (12) | 0.0141 (12) | −0.0019 (10) | 0.0005 (10) | −0.0025 (10) |
| O34 | 0.0149 (9) | 0.0029 (9) | 0.0105 (8) | 0.0033 (7) | 0.0020 (7) | 0.0020 (6) |
| O41 | 0.0121 (12) | 0.0076 (13) | 0.0163 (12) | 0.0023 (10) | 0.0057 (10) | 0.0025 (10) |
| O42 | 0.0117 (12) | 0.0081 (13) | 0.0144 (12) | 0.0034 (10) | 0.0007 (10) | −0.0003 (10) |
| O43 | 0.0107 (12) | 0.0097 (14) | 0.0128 (12) | −0.0002 (10) | −0.0021 (10) | −0.0036 (10) |
Geometric parameters (Å, º) top
| M1—O32i | 2.065 (3) | Li5A—Li5B | 0.65 (2) |
| M1—O23ii | 2.102 (3) | Li5A—O31i | 1.891 (13) |
| M1—O22 | 2.113 (3) | Li5A—O14 | 1.960 (14) |
| M1—O43iii | 2.136 (3) | Li5A—O13viii | 1.970 (14) |
| M1—O33iv | 2.277 (3) | Li5A—O22 | 2.173 (18) |
| M2—O41 | 2.020 (3) | Li5B—O31i | 1.86 (2) |
| M2—O42i | 2.056 (3) | Li5B—O14 | 1.95 (2) |
| M2—O32v | 2.091 (3) | Li5B—O13viii | 1.98 (3) |
| M2—O43v | 2.173 (3) | Li5B—O31viii | 2.24 (3) |
| M2—O33 | 2.207 (3) | P1—O11 | 1.520 (3) |
| M3—O41 | 1.891 (5) | P1—O13 | 1.526 (3) |
| M3—O21iii | 1.921 (5) | P1—O14 | 1.528 (3) |
| M3—O21 | 1.980 (5) | P1—O12 | 1.608 (2) |
| M3—O43i | 1.982 (5) | P2—O21 | 1.504 (3) |
| Co4—O11 | 2.079 (2) | P2—O22 | 1.532 (3) |
| Co4—O23 | 2.086 (3) | P2—O23 | 1.534 (3) |
| Co4—O13vi | 2.103 (3) | P2—O12 | 1.614 (3) |
| Co4—O33vi | 2.137 (2) | P3—O31 | 1.510 (3) |
| Co4—O42 | 2.192 (3) | P3—O32 | 1.526 (3) |
| Co4—O14vii | 2.205 (3) | P3—O33 | 1.550 (3) |
| Li4—O31iv | 1.942 (7) | P3—O34 | 1.611 (3) |
| Li4—O22 | 1.948 (7) | P4—O41 | 1.508 (3) |
| Li4—O11vii | 1.978 (7) | P4—O42 | 1.511 (3) |
| Li4—O14viii | 2.195 (8) | P4—O43 | 1.556 (2) |
| Li4—O13viii | 2.304 (7) | P4—O34 | 1.608 (3) |
| | | |
| O11—P1—O13 | 112.74 (15) | O43iii—M1—O33iv | 82.37 (10) |
| O11—P1—O14 | 115.41 (15) | O41—M2—O32v | 88.50 (11) |
| O13—P1—O14 | 108.82 (15) | O42i—M2—O32v | 115.31 (12) |
| O11—P1—O12 | 107.10 (14) | O41—M2—O43v | 157.78 (12) |
| O13—P1—O12 | 106.15 (14) | O42i—M2—O43v | 108.27 (11) |
| O14—P1—O12 | 105.98 (14) | O32v—M2—O43v | 93.53 (11) |
| O21—P2—O22 | 111.07 (15) | O41—M2—O33 | 87.22 (11) |
| O21—P2—O23 | 114.34 (15) | O42i—M2—O33 | 84.65 (11) |
| O22—P2—O23 | 112.40 (15) | O32v—M2—O33 | 159.64 (12) |
| O21—P2—O12 | 103.93 (14) | O43v—M2—O33 | 83.22 (11) |
| O22—P2—O12 | 107.07 (14) | O41—M3—O21iii | 98.9 (2) |
| O23—P2—O12 | 107.34 (14) | O41—M3—O21 | 125.0 (2) |
| O31—P3—O32 | 115.63 (15) | O21iii—M3—O21 | 91.3 (2) |
| O31—P3—O33 | 112.46 (14) | O41—M3—O43i | 108.9 (2) |
| O32—P3—O33 | 110.39 (14) | O21iii—M3—O43i | 123.4 (2) |
| O31—P3—O34 | 103.88 (14) | O21—M3—O43i | 109.6 (2) |
| O32—P3—O34 | 105.58 (14) | O11—Co4—O23 | 94.43 (10) |
| O33—P3—O34 | 108.18 (15) | O11—Co4—O13vi | 84.73 (10) |
| O41—P4—O43 | 110.60 (15) | O23—Co4—O13vi | 170.26 (10) |
| O42—P4—O43 | 111.41 (15) | O11—Co4—O33vi | 177.87 (10) |
| O41—P4—O34 | 106.18 (14) | O23—Co4—O33vi | 84.55 (10) |
| O42—P4—O34 | 104.57 (14) | O13vi—Co4—O33vi | 95.97 (10) |
| O43—P4—O34 | 107.38 (15) | O11—Co4—O42 | 98.65 (10) |
| O32i—M1—O23ii | 92.18 (10) | O23—Co4—O42 | 84.32 (10) |
| O32i—M1—O22 | 98.69 (11) | O13vi—Co4—O42 | 105.40 (10) |
| O23ii—M1—O22 | 110.44 (10) | O33vi—Co4—O42 | 83.11 (10) |
| O32i—M1—O43iii | 94.01 (10) | O11—Co4—O14vii | 89.09 (10) |
| O23ii—M1—O43iii | 99.71 (10) | O23—Co4—O14vii | 87.36 (10) |
| O22—M1—O43iii | 146.63 (10) | O13vi—Co4—O14vii | 82.93 (10) |
| O32i—M1—O33iv | 171.39 (10) | O33vi—Co4—O14vii | 89.00 (10) |
| O23ii—M1—O33iv | 80.79 (10) | O42—Co4—O14vii | 169.04 (10) |
| O22—M1—O33iv | 88.49 (10) | | |
| Symmetry codes: (i) x+1/2, −y+1/2, z; (ii) x+1/2, −y+3/2, z; (iii) −x+1, −y+1, −z; (iv) x, y+1, z; (v) −x+1, −y, −z; (vi) x−1/2, −y+1/2, z; (vii) −x+1, −y+1, −z+1; (viii) −x+3/2, y+1/2, −z+1. |
Experimental details
| Crystal data |
| Chemical formula | Li4.03Co1.97(P2O7)2 |
| Mr | 491.94 |
| Crystal system, space group | Monoclinic, P21/a |
| Temperature (K) | 293 |
| a, b, c (Å) | 9.817 (2), 9.741 (3), 11.012 (2) |
| β (°) | 101.76 (2) |
| V (Å3) | 1030.9 (4) |
| Z | 4 |
| Radiation type | Mo Kα |
| µ (mm−1) | 3.88 |
| Crystal size (mm) | 0.20 × 0.18 × 0.15 |
| |
| Data collection |
| Diffractometer | Enraf–Nonius CAD-4
diffractometer |
| Absorption correction | – |
No. of measured, independent and
observed [I > 2σ(I)] reflections | 3721, 2191, 1831 |
| Rint | 0.053 |
| (sin θ/λ)max (Å−1) | 0.638 |
| |
| Refinement |
| R[F2 > 2σ(F2)], wR(F2), S | 0.038, 0.100, 1.05 |
| No. of reflections | 2191 |
| No. of parameters | 217 |
| No. of restraints | 4 |
| Δρmax, Δρmin (e Å−3) | 0.89, −0.86 |
Selected bond lengths (Å) top| M1—O32i | 2.065 (3) | Li5A—O31i | 1.891 (13) |
| M1—O23ii | 2.102 (3) | Li5A—O14 | 1.960 (14) |
| M1—O43iii | 2.136 (3) | Li5A—O13viii | 1.970 (14) |
| M1—O33iv | 2.277 (3) | Li5A—O22 | 2.173 (18) |
| M2—O41 | 2.020 (3) | Li5B—O31i | 1.86 (2) |
| M2—O42i | 2.056 (3) | Li5B—O14 | 1.95 (2) |
| M2—O32v | 2.091 (3) | Li5B—O13viii | 1.98 (3) |
| M2—O43v | 2.173 (3) | Li5B—O31viii | 2.24 (3) |
| M2—O33 | 2.207 (3) | P1—O11 | 1.520 (3) |
| M3—O41 | 1.891 (5) | P1—O13 | 1.526 (3) |
| M3—O21iii | 1.921 (5) | P1—O14 | 1.528 (3) |
| M3—O21 | 1.980 (5) | P1—O12 | 1.608 (2) |
| M3—O43i | 1.982 (5) | P2—O21 | 1.504 (3) |
| Co4—O11 | 2.079 (2) | P2—O22 | 1.532 (3) |
| Co4—O23 | 2.086 (3) | P2—O23 | 1.534 (3) |
| Co4—O13vi | 2.103 (3) | P2—O12 | 1.614 (3) |
| Co4—O33vi | 2.137 (2) | P3—O31 | 1.510 (3) |
| Co4—O42 | 2.192 (3) | P3—O32 | 1.526 (3) |
| Co4—O14vii | 2.205 (3) | P3—O33 | 1.550 (3) |
| Li4—O31iv | 1.942 (7) | P3—O34 | 1.611 (3) |
| Li4—O22 | 1.948 (7) | P4—O41 | 1.508 (3) |
| Li4—O11vii | 1.978 (7) | P4—O42 | 1.511 (3) |
| Li4—O14viii | 2.195 (8) | P4—O43 | 1.556 (2) |
| Li4—O13viii | 2.304 (7) | P4—O34 | 1.608 (3) |
| Li5A—Li5B | 0.65 (2) | | |
| Symmetry codes: (i) x+1/2, −y+1/2, z; (ii) x+1/2, −y+3/2, z; (iii) −x+1, −y+1, −z; (iv) x, y+1, z; (v) −x+1, −y, −z; (vi) x−1/2, −y+1/2, z; (vii) −x+1, −y+1, −z+1; (viii) −x+3/2, y+1/2, −z+1. |
Analyse CD de la coordinence des cations dans la structure du phosphate
étudié top| Cation | q(i).sof(i) | Q(i) | CN(i) | ECoN(i) | Dmoy(i) | Dmed(i) |
| M1 | 1,597 | 1,592 | 5 | 4,858 | 2,245 | 2,124 |
| M2 | 1,321 | 1,310 | 5 | 4,802 | 2,110 | 2,095 |
| M3 | 1,102 | 1,092 | 4 | 3,936 | 1,943 | 1,937 |
| Co4 | 2,00 | 1,989 | 6 | 5,891 | 2,134 | 2,127 |
| Li4 | 1,00 | 0,981 | 5 | 4,185 | 2,074 | 2,004 |
| Li5A | 0,601 | 0,596 | 4 | 3,672 | 1,998 | 1,965 |
| Li5B | 0,390 | 0,379 | 4 | 3,371 | 2,010 | 1,943 |
| P1 | 5,00 | 5,032 | 4 | 3,927 | 1,544 | 1,539 |
| P2 | 5,00 | 5,038 | 4 | 3,905 | 1,546 | 1,539 |
| P3 | 5,00 | 4,984 | 4 | 3,913 | 1,550 | 1,544 |
| P4 | 5,00 | 5,007 | 4 | 3,908 | 1,546 | 1,539 |
| q(i).sof(i) = ? [Please define]
M1 = Li0,40CoII0,60;
M2 = Li0,68CoII0,32;
M3 = Li0,95CoIII0,05;
σ = [Σi(qi - Qi)2/N - 1]1/2 = 0,02. |
 Subscribe to Acta Crystallographica Section C: Structural Chemistry
Subscribe to Acta Crystallographica Section C: Structural Chemistry
The full text of this article is available to subscribers to the journal.
If you have already registered and are using a computer listed in your registration details, please email
support@iucr.org for assistance.
![[Figure 1]](http://journals.iucr.org/c/issues/2010/01/00/dn3129/dn3129fig1thm.gif)
![[Figure 2]](http://journals.iucr.org/c/issues/2010/01/00/dn3129/dn3129fig2thm.gif)
 Subscribe to Acta Crystallographica Section C: Structural Chemistry
Subscribe to Acta Crystallographica Section C: Structural Chemistry
 journal menu
journal menu




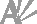

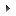
 Subscribe to Acta Crystallographica Section C: Structural Chemistry
Subscribe to Acta Crystallographica Section C: Structural Chemistry



Les phosphates et arséniates mixtes de cobalt et de métaux alcalins présentent de nombreuses propriétés physico-chimiques en relation avec leurs structures. La famille LiMPO4 (M = Mn, Fe, Co) (Padhi et al., 1997; Amine et al., 2000; Li et al., 2002) de structure olivine montre des propriétés électrochimiques comme électrodes positives; le phosphate LiCoPO4 possède en plus des propriétés piézo-magnétoélectriques (Rivera & Schmid, 1994; Kornev et al., 1999). Dans la plupart des matériaux connus, le cobalt est au degré d'oxydation II. Peu de travaux ont été consacrés à l'incorporation d'une valence mixte de ce métal dans la charpente inorganique. Ces matériaux sont susceptibles de présenter des propriétés catalytiques suite à la possibilité d'existence de réactions d'oxydoréduction réversibles combinant les différentes espèces du cobalt (Lee & Chon, 1996). Nous reportons dans ce travail l'étude structurale d'un phosphate mixte de cobalt(II/III) et de lithium, Li4.03Co1.97(P2O7)2, le seul à notre connaissance. La structure est élucidée en se basant sur les analyses structurale et de distribution de charge (CHARDI).
La méthode CHARDI ou CD, introduite par Hoppe et al. (1989) et améliorée ensuite par Nespolo et al. (2001), est le développement le plus récent de la théorie classique de la force de liaison (Pauling, 1929), et diffère de l'approche des valences de liaisons (BV) (par exemple Brown, 1987) par l'exploitation des distances interatomiques seulement, au lieu d'employer des courbes empiriques. La méthode CHARDI est utilisée en raison, en plus de la validation, des détails structuraux qu'elle apporte en même temps [nombre de coordination effectif ECoN, distance arithmétique pondérée (de l'anglais: weighted arithmetic distance)]. Par ailleurs, la méthode CD a servi pour élucider la non-stoichiométrie de YbFeMnO4 (Nespolo et al., 2000) et le déficit anionique de Na7As11O31 (Guesmi et al., 2006), pour examiner les changements structuraux, par exemple en fonction de la température et de la pression (Nespolo et al., 2001) etc.
La structure de Li4.03Co1.97(P2O7)2 renferme sept positions cationiques dont trois possédant des occupations mixtes (Fig. 1): le site M1 d'environnement anionique ayant la forme d'une pyramide à base carrée, le site M2 d'environnement bipyramidal trigonal et le site M3 avec une coordinence tétraédrique. Les occupations des deux sites M1 et M2 sont affinées en premier lieu comme étant occupées par les ions Co2+, cependant les charges calculées (Q) sont nettement inférieures à la charge formelle de ces ions (II), l'affinement a porté sur les occupations de ces deux sites qui ont dévié de l'occupation totale, les charges calculées sont cette fois supérieures aux valeurs affinées. Pour compléter la charge, nous sommes donc amenés à affiner le désordre dans ces deux positions en considérant la présence aussi d'un cation de valence plus faible: l'ion alcalin. Cette fois l'accord entre les charges calculées et affinées est satisfaisant.
Pour le site M3 possédant un environnement tétraédrique, les distances interatomiques excluent la possibilité de présence des cations Co2+ et cette position peut correspondre donc aux cations les plus petits Co3+ et/ou Li+. Si l'on considère en première hypothèse que cette position est occupée par les cations trivalents, le facteur d'agitation thermique isotrope est anormalement élevé. Le résultat est nettement amélioré en affinant l'occupation de ce site qui est réduit à 0,14 avec un Uiso raisonnable et un résidu non significatif. Cependant, les occupations des positions anioniques n'ont pas dévié de l'occupation totale et la neutralité électrique est ainsi non assurée. La deuxième hypothèse d'une occupation totale par les ions alcalins a été exclue pour des anomalies similaires. La charge calculée relative au site M3, si occupé par les ions Co3+, dépasse significativement la valence affinée (q.sof [Please define], q = III), et le facteur de dispersion σ (Nespolo, 2001) qui mesure la déviation des charges calculées (Q) par rapport aux nombres d'oxydation (q) est assez élevé, ceci constitue donc un indice de la présence aussi des cations alcalins. L'affinement de l'occupation mixte de ce site montre, en plus du lithium, une fraction des ions Co3+, environ 5,26% du contenu total en cobalt. Un quatrième site est occupé totalement par les ions CoII avec un environnement octaédrique d'atomes d'oxygène. Les autres sites cationiques sont occupés par les cations monovalents avec désordre de l'un d'eux sur deux positions indépendantes à une distance Li5A—Li5B = 0,65 Å.
L'affinement final du désordre cationique a réduit les facteurs de reliabilté et a amélioré les facteurs d'agitation thermique. Les charges calculées des différents cations occupant les trois sites M1 à M3 ainsi que des autres cations correspondent bien aux valeurs affinées et le modèle structural proposé correspondant à la formule Li4+xCo2-x(P2O7)2 (x = 0,03) est donc validé par la méthode CD avec un facteur de dispersion de 2%. L'occupation simultanée d'un même site par les ions Co2+/3+ et Li+ a été observée dans plusieurs bronzes de cobalt LixCoyO2 (par exemple Gummow et al., 1993) et dans Li5,88Co5,06(P2O7)4 (Sanz et al., 2000).
La structure renferme, en plus des polyèdres métalliques, quatre tétraèdres PO4 formant deux groupements diphosphate. La géométrie des différents polyèdres de coordination est analysée par la méthode CD (tableau 2). Le nombre de coordination effectif ECoN, base de cette méthode, donne non seulement le nombre d'atomes coordonnés à un atome central dans un polyèdre mais aussi le poids relatif de chacun de ces atomes en fonction de leurs distances. L'écart par rapport à la géométrie idéale se répercute sur les ECoNs qui s'écartent des nombres de coordination (CN) avec la distortion. Les distances arithmétiques pondérées Dmed sont inférieures à la distance moyenne classique Dmoy dans chaque polyèdre, on peut noter que l'écart entre ces deux valeurs évolue avec celui entre l'ECoN et la coordinence CN, c'est à dire quand les polyèdres deviennent de plus en plus déformés.
Le réseau tridimensionnel de Li4,03Co1,97(P2O7)2 (Fig. 2) peut être décomposé en deux types de couches polyédriques. Le premier type, dans le plan ab et d'épaisseur égale environ au paramètre c, résulte de la jonction entre les octaèdres CoO6 partageant tous leurs sommets avec les groupements diphosphate. Entre les couches de ce premier type sont intercalées des couches d'un second type formées par les polyèdres (Co,Li)On (n = 4 et 5). Ce deuxième type de couches peut se décomposer en chaînes de dimères (Co,Li)2O10 partageant des sommets et les groupements M2O7 (M = Li0,95Co0,05) assurent la jonction entre ces chaînes. Les cations monovalents Li4 et Li5A/5B logent dans les cavités de ce réseau et apparaissent selon des tunnels parallèles à la direction a.
Les différentes caractéristiques structurales (valence mixte, désordre) font de ce phosphate un matériau original. Les résultats présentés sont basés sur le couplage de l'analyse structurale à l'analyse CD. D'autres tentatives d'exploration des systèmes Li–Co–P/As–O, pouvant conduire à la production de nouvelles phases imprévues comme pour le cas étudié, sont envisagées.